用語解説 第13回テーマ: リチウムイオン電池
2020/08/21

世古口雅宏 〔(株)日立製作所〕
1. リチウムイオン電池の位置付け
リチウムイオン電池とは,非水電解質二次電池の一種で,電解質中のリチウムイオンが電気伝導を担う二次電池である。表1 に示すように電池を分類すると再使用不可の一次電池と充電で再使用可能な二次電池に分類される。また,用いられる電解液の種類により,水系電解液電池と非水系電解液電池とに分類される。
表1 リチウムイオン電池の位置付け
| 水系電解液電池 | 非水系電界液電池 (高電圧・高容量) |
|
| 一次電池 (再使用不可) |
マンガン乾電池 アルカリ乾電池 |
金属リチウム 一次電池 |
| 二次電池 (充電再使用可能) |
鉛電池 ニッカド電池 ニッケル水素電池 |
リチウムイオン 二次電池 |
2. リチウムイオン電池の原理と特長
(1) 原理
負極にグラファイト,正極にコバルト酸リチウムLiCoO2を用いるリチウムイオン電池の反応を図1 に示す。正負極間にはLiPF6 をエチレンカーボネート(EC)とジエチルカーボネート(DEC)などに溶解させた有機電解液を充填する。セパレータには多孔性オレフィン膜が用いられる。2000 年代に入り正極では材料の低コスト化,資源量制約からの脱却のため脱・省コバルト化を目指し,マンガン酸化物等の電極が実用化されている。負極は主に高容量化を目指し,Sn 系,Si 系のリチウム合金が,また逆に性能の一
部を犠牲にして安全性,入出力特性,サイクル特性の向上を目指したチタン酸リチウムが実用化されている。
(a) 構成
図1 の電池の構成は次のようになる。
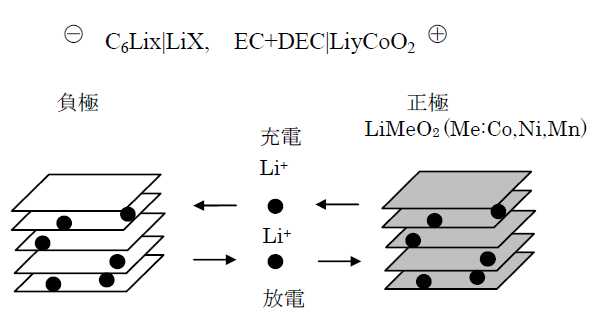
図1 リチウムイオン電池の充放電反応の模式図
(b) 電池反応
放電反応ではLi が負極活物質の炭素から正極活物質の酸化物に移動する反応になる。充電反応はその逆になる。この炭素中に挿入されるLi の量は炭素材料によって異なり,負極活物質としてのグラファイトではC6Li まで入る。
負 極:C6Lix → 6C + xLi+ + xe
正 極:LiyCoO2 + xLi+ + xe → Lix + yCoO2
全反応:C6Lix + LiyCoO2 → 6C + xLi+ + Lix + yCoO2
(2) 特徴
上記基本構成材料及び電池反応原理に基づき発揮されるリチウムイオン電池の特長は次の通りである。
(a) 高起電力・小型・軽量化
非水系電解液のため4V以上の起電力が得られ,エネルギー密度の大幅な向上,即ち二次電池の小型・軽量化が実現した。水系電解液電池で
は1.5V 前後の起電力である。
(b) 低自己放電率
原理的に化学的変化を伴わない電池反応に基づくため,副反応による劣化がなく優れたサイクル性,保存特性等の長期安定な電池特性が実現した。
(c) 環境性
他の二次電池のようなCd,鉛等の有害物質を含まない。
(d) メモリ効果がない
ニッケル系電池の短所であるメモリ効果(浅い充放電を繰り返すと容量が減少する)がない。
3. 最近の動向
従来の二次電池にない高エネルギー密度を持つので,携帯用電子機器の電源として用途を拡大している。ビデオムービー,携帯電話,携帯パソコンなど,電力消費の比較的大きいコードレス電子機器の多くに使われ,またボタン電池のような小型のものはメモリバックアップなどに大量に使われている。
また,高性能であるので,電気自動車(EV),ハイブリッド自動車(HEV)及びプラグインハイブリッド車(PHEV)用の大型のものも開発に向けて努力されている。
更にはCO2排出量低減を可能とする新エネルギー発電(風力・太陽光発電)の出力平滑化・安定化(系統連系円滑化)用途にも本二次電池の応用が期待されている。
文献
(1) 電気工学ハンドブック,第6版,p.1874,pp.1882-1883,電気学会 (2001-2)
(2) 竹井勝仁:「重要性が増してきた二次電池技術の最前線」,電学誌,Vol. 130,No. 5,pp.280-284 (2010)

